拟在昆明医科大学第一附属医院开展的临床试验,请按以下流程进行项目立项审核。
一、立项沟通
1、拟在本中心开展各类临床试验的申办方/CRO,可联系机构办公室和专业负责人,初步商定临床试验项目承接意向。
2、专业负责人和机构办一致确定临床试验项目承接意向后,申办方按“临床试验立项资料审核清单”(表1)准备资料,并以“XXXX(试验药物名称、器械)+适应症立项资料+申办方”为邮件主题,将项目资料发送至机构办和专业负责人/主要研究者邮箱。
表1. 临床试验立项资料审核清单
| 文件名称 | 版本号及日期 |
| 临床试验批准通知书、CDE沟通函 |
|
| 临床试验方案 |
|
| 知情同意书 |
|
| 招募受试者的相关材料 |
|
| 病例报告表样表 |
|
| 研究者手册/前期研究情况 |
|
| 主要研究者履历、执业证明以及GCP培训证 |
|
| 受试者相关文件、资料 |
|
| 试验品检验合格报告、包装、标签 |
|
| 对照品检验合格报告、包装、标签、使用说明书 |
|
| 申办方/CRO资质文件 |
|
| 临床研究系统备案登记证明 |
|
| 项目招募广告 |
|
| 其它材料 |
|
| 备注:机构办联系邮箱kyfyygcp@sina.com | |
3、发送材料后,联系相应的机构办公室临床科室联络员,联系方式见《昆医大附一院临床试验相关工作人员联系方式》。
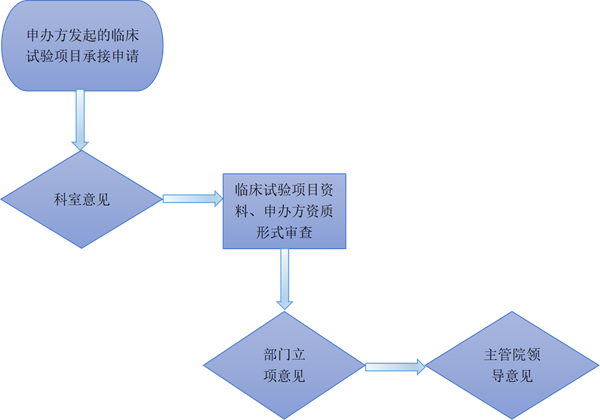
二、临床试验项目的立项审核
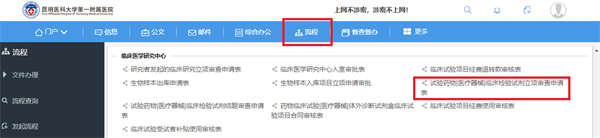
1、请研究者在医院OA办公系统中,流程→临床医学研究中心→试验药物|医疗器械|临床试验试剂立项审查申请表(图1.),按照流程要求提交立项申请进行逐级审核。
图1. 临床试验立项审查申请
2、审核过程中,研究者可通过OA办公系统查询办理进度,及时掌握审核反馈。
3、临床试验立项审核通过后,会自动发送本中心伦理委员会,并按照本中心伦理委员会工作要求进行伦理审查。
三、立项审核流程图